Sie sind hier
Qualifizierung
Qualifizierung/ Validierung
Qualitativ gut zu arbeiten bzw. zu produzieren ist eine der wichtigsten Zielsetzung jedes Unternehmens. Qualität bedeutet, dass Ihr Produkt nach Ihren Vorgaben zu jedem Zeitpunkt in gleichbleibender Qualität produziert werden kann. - Mögliche Abweichungen werden erkannt und behoben. Wie ist dies möglich? - Dies kann nur dann konsequent umgesetzt werden, wenn Sie in Ihrem Betrieb genaue Vorgaben erlassen bzw. genaue Vorkehrungen treffen, dass alle Aufgaben möglichst ohne Fehler oder Abweichungen durchgeführt werden können. Dazu gibt es die ISO-Normen, welche Empfehlungen vorschlagen.
Um diese Zielsetzung zu erfüllen stehen wir Ihnen sehr gerne zur Verfügung. - Sei es in der Umsetzung von unternehmensinternen Abläufen wie Angebotsbear-beitung, Auswertungen, Projektbearbeitung oder anderen Aufgaben.
Im Produktionsbereich sind, vor allem im pharma- und medizinischen Bereich Vorgaben von swissmedic (BAG, Bundesamt für Gesundheit), der europäischen Gesundheitsbehörde (EMA) oder auch der amerikani-schen Gesundheitsbehörde FDA Folge zu leisten. Selbstverständlich gibt es weitere für andere Länder. - Diese Vorgaben werden als Empfehlungen an die Unternehmen weitergegeben und diese wiederum haben die Empfehlungen auf ihr Produkt resp. auf ihre Produktionstechnik abzugleichen. Um die Produktion einem hohen Qualitätsstandard zu unterziehen und den zu halten, können wir Ihnen unser mehr als 12 jähriges Wissen zur Verfügung stellen.
Nach der Erarbeitung des Masterqualifizierungsplans und den daraus resultierenden Qualifizierungsplänen entstehen verschiedene Anforderungen um eine Qualifizierung/ Validierung durchzuführen. Schwergewichtig befassen wir uns mit CSV (Computer System Validation) und den damit verbundenen Aufgaben. Die Risikoanlyse (FMEA, Failure Mode and Effects Analysis) 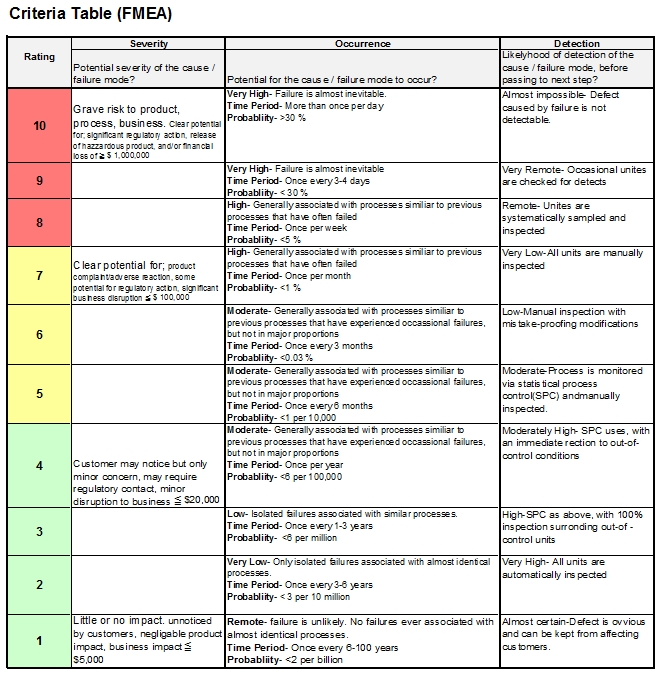 bildet ein wesentlicher Aspekt zur Ausarbeitung des Qualifizierungsplans für eine Produktionsanlage. Mit unserem Wissen möchten wir Ihnen Lösungswege aufzeigen, welche auch den nichtqualifizierungstechnischen Aspekten Rechnung trägt. - Dabei ist für uns der Kosten- Nutzeneffekt im Vordergrund. - Eine klare Abgrenzung zwischen pharmazeutischer Relevanz und Nichtrelevanz ist wesentlich um die Gesamtkosten möglichst im Griff zu haben.
bildet ein wesentlicher Aspekt zur Ausarbeitung des Qualifizierungsplans für eine Produktionsanlage. Mit unserem Wissen möchten wir Ihnen Lösungswege aufzeigen, welche auch den nichtqualifizierungstechnischen Aspekten Rechnung trägt. - Dabei ist für uns der Kosten- Nutzeneffekt im Vordergrund. - Eine klare Abgrenzung zwischen pharmazeutischer Relevanz und Nichtrelevanz ist wesentlich um die Gesamtkosten möglichst im Griff zu haben.
Mit unserem Wissen können wir dem Programmierer schon in der Planungsphase geeignete Programmiertechniken vorgeben, um z.B. die Empfehlungen gemäss 21 CFR Part 11 resp. GAMP 5 einzuhalten. - Damit vereinfacht sich FAT (factory acceptance test) und SAT (side acceptance test) und natürlich die Qualifizierungsphasen DQ, IQ, OQ, PQ.
Von Projektbeginn bis zum Abschluss der Qualifizierung und Übergabe an die Produktion stehen wir für Sie zur Verfügung.
Sprechen Sie uns an...

